O carbono e a diversidade molecular dos seres vivos
O carbono faz parte tanto de moléculas pequenas, por exemplo as do CO2 encontrado na atmosfera, quanto de moléculas enormes, como os lipídios, com milhares de átomos. O átomo de carbono tem propriedades especiais que o tornam muito versátil em ligações com outros átomos.
A primeira camada eletrônica que circunda o núcleo do átomo tem dois elétrons, o que é suficiente para estabilizá-la. Mas a segunda camada eletrônica, que se estabiliza com oito elétrons, tem apenas quatro. Isso significa que o carbono está sempre “disposto” a compartilhar dois pares de elétrons, ou seja, ele tem valência 4: é tetravalente (figura 3.3). Veja a figura 3.4, que ilustra uma cadeia carbônica.
de átomos de carbono, denominada cadeia carbônica.
Os átomos de carbono comumente compensam os quatro elétrons que faltam em sua última camada eletrônica, compartilhando seus elétrons com os de outros átomos, até completar oito elétrons nessa camada. Isso representa uma tendência à formação de moléculas longas (figura 3.4), pois um átomo de carbono pode se ligar a até quatro outros átomos, incluindo de carbono.
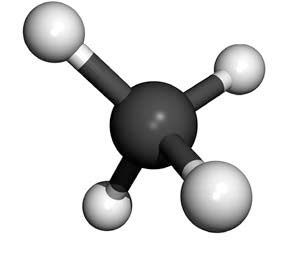
Quando os átomos de carbono se ligam a quatro átomos de hidrogênio, por exemplo, todos se estabilizam. Veja as figuras 3.5 e 3.6; é assim que se forma a molécula de metano (CH4). Um átomo de carbono pode formar ligações covalentes com outros átomos de carbono. O esquema da figura 3.7 exemplifica as três situações possíveis.

carbono e quatro átomos de hidrogênio ao seu redor.
Nas ligações covalentes, os átomos de carbono podem se ligar a outros átomos de carbono em diferentes arranjos: compartilhando apenas um elétron (ligação simples), dois elétrons (ligação dupla), ou até mesmo três elétrons (ligação tripla). Essa capacidade de os átomos de carbono formarem ligações covalentes com outros átomos, incluindo de carbono, explica sua grande versatilidade para a formação de estruturas moleculares. Isso possibilita a existência do grande número de moléculas diferentes, indispensáveis aos organismos vivos.

Átomos de carbono que compartilham elétrons com átomos de hidrogênio tendem a se unir e formar um conjunto, como se fossem vagões de um trem.

Um átomo de carbono compartilhando elétrons com átomos de hidrogênio e carbono, um de cada lado, estará estabilizado. Observe no esquema da figura 3.9 como os dois átomos de carbono do centro (em verde) completaram sua camada eletrônica, compartilhando quatro elétrons (em vermelho).

O problema dos átomos que funcionam como “vagões do meio do trem” está resolvido, ou seja, eles estão estáveis. No entanto, restam os átomos de carbono das duas pontas, isto é, os átomos de carbono que têm parceiro apenas de um dos lados. Esses átomos de carbono são especiais e, por isso, recebem uma designação distintiva, como “alfa” e “ômega” – o primeiro e o último da cadeia, tenha ela quantos átomos tiver.
A figura abaixo mostra uma molécula muito comum no azeite de oliva.
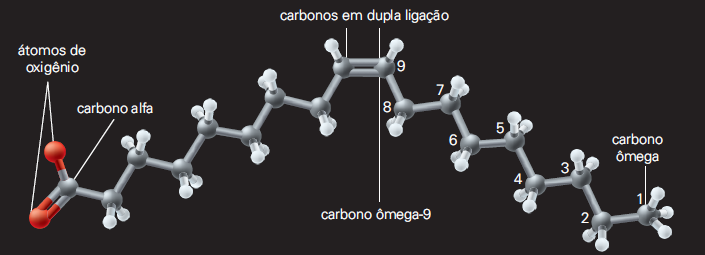
Trata-se do ácido oleico, cuja molécula não é retilínea, devido a uma ligação covalente dupla no nono carbono da cadeia. Tal característica confere uma série de propriedades a outras estruturas, como veremos adiante. Essa substância é um ácido graxo ômega-9, ou seja, o “cotovelo” de sua molécula está no nono carbono a partir do carbono ômega. Isso explica a facilidade do carbono em formar cadeias lineares longas. Os átomos de carbono das extremidades “procuram” se estabilizar de diversas formas; por exemplo, combinando-se com átomos de hidrogênio. Um modo de estabilizar todos os átomos de carbono em uma cadeia longa pode ser a formação de uma dobra, dando à molécula o aspecto de anel.
Observe, na figura abaixo.

Como a mesma cadeia representada nessa outra figura:
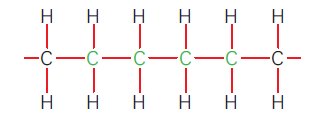
Pode se estabilizar ao formar um anel. Esses anéis resolvem o problema de estabilidade dos átomos de carbono em certas situações. É possível perceber como a Geometria molecular é importante na Química orgânica. Adiante você conhecerá três açúcares com mesma fórmula química, mas que formam substâncias diferentes por causa de diferenças em sua geometria molecular. A seguir vamos estudar alguns compostos orgânicos moleculares que são importantíssimos para todos os seres vivos conhecidos. Suas moléculas são, por isso, denominadas biomoléculas.
Referências:
Bizzo, Nélio Novas bases da biologia / Nélio Bizzo. – 2. ed. – São Paulo : Ática, 2013. Conteúdo : v. 1 Células, organismos e populações – v. 2 Biodiversidade – v.3 Corpo humano, genes e ambiente