A base química dos seres vivos
A base química dos seres vivos
À primeira vista, os seres vivos são muito diferentes entre si. Uma bactéria, um arquea, uma ameba, um fungo, uma árvore e um vertebrado aparentemente têm poucas características em comum. De fato, acabamos de ressaltar suas diferenças. No entanto, eles têm uma base química comum. A primeira característica básica é a dependência de água. Podemos afirmar, sem margem de erro, que a base da vida na Terra é a água, uma substância cuja molécula apresenta propriedades muito especiais. A vida depende ainda de outras moléculas, nas quais o carbono é um elemento de
grande importância.
A água e suas propriedades emergentes
A água é representada pela conhecida fórmula molecular H2O, que significa que uma molécula dessa substância é formada por dois átomos de hidrogênio, ligados a um de oxigênio. Existe uma desproporcional habilidade de atrair elétrons entre esses átomos, pois o átomo de oxigênio consegue “sugar” os elétrons dos dois átomos de hidrogênio da molécula. Assim, uma parte da molécula de água está, de certa forma, rica em elétrons, enquanto outra parte está pobre, ou carente, deles, embora haja um equilíbrio na “contabilidade geral” de cargas elétricas na molécula. A parte próxima ao núcleo do átomo de oxigênio tem um vestígio adicional de carga negativa, enquanto cada núcleo dos átomos de hidrogênio, parcialmente privado de seu respectivo elétron, passa a ter um vestígio adicional de carga positiva. Assim, a molécula de água fica polarizada.


Como vimos, há duas partes positivas e uma negativa numa mesma molécula de
água. Essa polaridade, em qualquer substância, já traria propriedades peculiares, mas
na água e em outras substâncias em que o hidrogênio é atraído por elementos muito
eletronegativos, como o oxigênio e o nitrogênio, aparece uma interação entre a parte
positiva da molécula (os átomos de hidrogênio) e a parte negativa de moléculas
vizinhas (os átomos de oxigênio ou nitrogênio), formando uma ligação de hidrogênio.

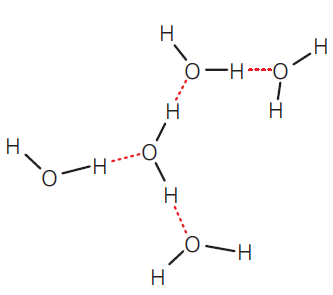
As ligações de hidrogênio também podem ser formadas entre moléculas de outras substâncias, além da água.

hidrogênio de uma molécula e o átomo de oxigênio ou nitrogênio de outra molécula.
Essas ligações, entretanto, não são muito fortes, o que permite a mobilidade das partículas típica do estado líquido, mas são suficientes para determinar um arranjo especial do conjunto de moléculas, devido à sua grande coesão – que explica, por exemplo, seu ponto de ebulição relativamente alto. Se a água não apresentasse ligações de hidrogênio, ao nível do mar ela entraria em ebulição a uma temperatura muito inferior a 100 °C.
Outra propriedade emergente é uma rigidez razoável da superfície de um pequeno volume de água líquida, a tensão superficial.

O peso dele não é sufi ciente para romper as ligações de hidrogênio entre as moléculas
de água da superfície e fazê-lo afundar.
É a tensão superficial que permite a um inseto caminhar sobre uma poça de água sem molhar as pernas! A tensão superficial também explica por que se formam – e se mantêm – as gotas de água.

Quando observamos uma gota de óleo e uma gota de água, ambas sobre a mesma superfície, fica evidente a diferença de conformação das duas gotas, que pode ser explicada pela diferença da força de coesão molecular nas duas substâncias.

A água e os sais minerais
Outra extraordinária propriedade da água é a capacidade de atuar como solvente. Muitos átomos são carregados eletricamente, formando os íons. Íons com cargas positivas são denominados cátions, e íons com cargas negativas são chamados anions.
O sal de cozinha é uma substância iônica composta por ânions de cloro \(\left(\mathrm{Cl}^{-}\right)\)e cátions de sódio \(\left(\mathrm{Na}^{+}\right)\). Na sua forma sólida, cada íon positivo está cercado de íons negativos e vice-versa. Mas, se colocarmos um pouco desse sal na água, que tem moléculas com uma parte carregada positivamente e outra carregada negativamente, esses íons serão cercados por moléculas de água.
Observe o esquema abaixo. Os íons de cloro \(\left(\mathrm{Cl}^{-}\right.\), em lilás no esquema) serão envolvidos pela parte da molécula de água onde os átomos de hidrogênio (em alaranjado) sobressaem (figura abaixo, à esquerda), e os íons de sódio \(\left(\mathrm{Na}^{+}\right.\), em verde no esquema) são cercados pela parte da molécula onde o átomo de oxigênio (em azul) sobressai.

cargas dos íons de cloro e sódio.
Essa característica da água faz com que ela seja um solvente extraordinário, capaz de transportar sais minerais na corrente sanguínea de diferentes animais e seres humanos, ou mesmo na seiva de plantas, além de atuar em inúmeras outras situações, como na erosāo de rochas e na moldagem da paisagem. Um ser humano precisa diariamente de cerca de \(500 \mathrm{mg}\) de sódio e \(750 \mathrm{mg}\) de cloro.
Os sais minerais são importantes para a saúde humana. Veremos adiante os elementos químicos importantes para os organismos vivos, que podem se combinar em ligações iônicas, formando sais solúveis em água. Sais de magnésio e potássio, por exemplo, são imprescindíveis para as plantas. Sais de cálcio e ferro, embora também importantes para as plantas, são necessários em quantidades relativamente maiores para os animais, em especial para os seres humanos.
A água e as vitaminas
Os alimentos são fontes de sais minerais, participam de diversas reações químicas no organismo e são continuamente reaproveitados. Além desses compostos iônicos, substâncias moleculares participam de reações químicas, acelerando-as sem serem consumidas. São as chamadas vitaminas. Adiante veremos como o aproveitamento de energia dos alimentos depende da presença de vitaminas do complexo B, que são solúveis em água. A vitamina C, muito comum em frutas cítricas, assim como as vitaminas do complexo B, também é solúvel em água. Algumas vitaminas, no entanto, não são solúveis em água, como as vitaminas A, D e E, sendo por isso encontradas em alimentos gordurosos.
Referências:
Bizzo, Nélio Novas bases da biologia / Nélio Bizzo. – 2. ed. – São Paulo : Ática, 2013. Conteúdo : v. 1 Células, organismos e populações – v. 2 Biodiversidade – v.3 Corpo humano, genes e ambiente